Воспользуйтесь поиском по сайту:
Плегриди
Плегриди: инструкция по применению и отзывы
Латинское название: Plegridy
Код ATX: L03AB13
Действующее вещество: пэгинтерферон бета-1а (Peginterferon beta-1a)
Производитель: Веттер Фарма-Фертигунг, ГмбХ и Ко. КГ (Vetter Pharma-Fertigung, GmbH & Co. KG) (Германия)
Актуализация описания и фото: 27.10.2021
Цены в аптеках: от 25641 руб.
Плегриди – иммуномодулирующее средство для лечения рассеянного склероза с ремиттирующим течением у взрослых.
Форма выпуска и состав
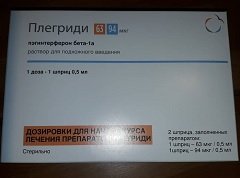
Выпускают препарат в форме раствора для подкожного (п/к) введения: слегка опалесцирующая или прозрачная, бледно-желтая или бесцветная жидкость [по 0,5 мл (63/94/125 мкг) в шприце из прозрачного бесцветного стекла, снабженном иглой из нержавеющей стали, закрытой колпачком из термопластического эластомера и полипропилена, и шток-поршнем с бромбутиловым уплотнителем; в пластиковом поддоне, запечатанном полимерной пленкой или бумагой, 1 шприц и инструкция по применению Плегриди; упаковка для начального курса – в картонной пачке 2 поддона (63 и 94 мкг), для продолжения курса – в картонной пачке 2 или 6 поддонов (125 мкг). По 0,5 мл (63/94/125 мкг) в стеклянном шприце, помещенном в пластиковую шприц-ручку для одноразового использования; в пластиковом поддоне 2 шприц-ручки (63 и 94 мкг или 125 и 125 мкг); упаковка для начального курса – в картонной пачке 1 поддон (63 и 94 мкг), для продолжения курса – в картонной пачке 1 поддон (2 шприц-ручки по 125 мкг), или в картонной коробке 3 пачки с 1 поддоном (2 шприц-ручки по 125 мкг); дозировки дополнительно отмечены различными цветами, оранжевым – 63 мкг, голубым – 94 мкг и серым – 125 мкг; инструкция по применению, вложенная в каждую картонную пачку, может быть в сложенном виде или в виде цветного буклета; пачки и/или коробки могут быть оснащены контролем первого вскрытия в виде стикера].
В 1 шприце/шприц-ручке содержатся:
- действующее вещество: пэгинтерферон бета-1а (в пересчете на белок) – 63, 94 или 125 мкг;
- дополнительные компоненты: натрия ацетат тригидрат, L-аргинина гидрохлорид, полисорбат 20, уксусная кислота ледяная, вода для инъекций.
Фармакологические свойства
Фармакодинамика
Активное вещество Плегриди – конъюгат интерферона бета-1а, генно-инженерным путем выделенный из клеток яичников китайского хомячка и одной линейной молекулы метоксиполиэтиленгликоль-О-2-метилпропиональдегида (мПЭГ), имеющей массу 20 кДа, в пропорции – 1 моль белка/1 моль полимера. У конъюгата средняя молекулярная масса составляет приблизительно 44 кДа, из которых на белок приходится около 23 кДа. Лекарственное средство не включает в состав консерванты.
Точный механизм действия препарата при терапии рассеянного склероза не установлен. Плегриди взаимодействует с рецепторами интерферона I типа на поверхности мембран клеток и приводит к запуску каскада внутриклеточных реакций, которые обеспечивают регулирование экспрессии зависимых от интерферона генов. Предполагается, что опосредованные препаратом биологические эффекты включают усугубление экспрессии противовоспалительных цитокинов, в т. ч. интерлейкина(ИЛ)-4, ИЛ-10, ИЛ-27, а также уменьшение экспрессии провоспалительных цитокинов, таких как интерферон-γ, ИЛ-2, ИЛ-12, фактор некроза опухоли α (ФНО-α), и блокирование прохождения через гематоэнцефалический барьер (ГЭБ) активированных Т-клеток. Однако могут использоваться и дополнительные механизмы. Ввиду того, что патофизиология рассеянного склероза установлена только частично, полностью выяснить способ взаимодействия пэгинтерферона бета-1а со специфическими участками связывания в организме не удалось.
Плегриди является интерфероном бета-1а, конъюгированным по N-концевому аминокислотному остатку альфа-аминогруппы с 1 линейной молекулой метоксиполиэтиленгликоля. Интерфероны связаны со многими клеточными реакциями, классифицируемыми как иммуномодулирующие, противовирусные, антипролиферативные. Фармакологические характеристики Плегриди соответствуют таковым для интерферона бета-1а и предположительно обусловлены белковой частью этой молекулы.
Фармакодинамические ответы на введение средства оценивали посредством замера индукции интерферонзависимых генов, в т. ч. и кодирующих 2',5'-олигоаденилатсинтетазу (2',5'-OAS), несколько цитокинов и хемокинов, белок А резистентности к миксовирусу (М×А) и неоптерин (D-эритро-1, 2, 3-тригидроксипропилптерин) – вещество, формирующееся при участии интерферон-индуцируемого фермента – гуанозинтрифосфатциклогидролазы 1 (GTPСH 1).
У здоровых добровольцев индуцирование генов было больше в отношении максимальной концентрации (Cmax) и экспозиции (значение площади под кривой «концентрация – время» – AUC), при сравнении с непэгилированным интерфероном бета-1а на фоне внутримышечного (в/м) введения последнего и Плегриди в одинаковой дозе, рассчитанной по активности – 6 миллионов международных единиц (6 ММЕ). Данный ответ отличался большей устойчивостью и наблюдался более длительно при использовании пэгинтерферона бета-1а: увеличенная концентрация фиксировалась до 15 дней по сравнению с 4 днями на фоне введений непэгилированного интерферона бета-1а.
Повышенный уровень неоптерина был выявлен как у здоровых добровольцев, так и у больных с рассеянным склерозом. Наряду с этим непрерывное и продолжительное возрастание на протяжении 10 дней отмечалось в случае применения Плегриди при сравнении с 5 днями при введениях непэгилированного интерферона бета-1а. Содержание неоптерина уменьшалась до исходных значений спустя две недели после использования пэгинтерферона бета-1а.
Безопасность и эффективность применения Плегриди у больных с ремиттирующим рассеянным склерозом, имеющих не менее 2 рецидивов за последние три года и 1 рецидив за последний год [сумма баллов по РШОИ (Расширенная Шкала Оценки Инвалидизации) ≤ 5], определялась на протяжении одного года в плацебо-контролируемой фазе двухлетнего рандомизированного двойного слепого исследования (ADVANCE). Пэгинтерферон бета-1а получали 1512 пациентов п/к в дозе 125 мкг 1 раз в 2 недели (n = 512) или 1 раз в 4 недели (n = 500), также пациенты получали плацебо (n = 500). Ежегодная частота рецидивов была первичной конечной точкой.
Используемый 1 раз в 2 недели на протяжении одного года препарат снижал на 36% частоту рецидивов при сравнении с плацебо. Эффект также сохранялся при анализе по подгруппам, которые были объединены согласно демографическим показателям и исходным характеристикам заболевания. Достоверно снижался риск рецидивов на 39% (р = 0,0003), а угроза стойкого прогрессирования инвалидизации спустя 12 недель приема на 38% (р = 0,0383), спустя 24 недели – на 54% (р = 0,0069). Количество ГД+-очагов (очагов, накапливающих гадолиний) снизилось на 86%, количество впервые увеличившихся либо новых Т2-очагов – на 67%, Т1-гипоинтенсивных очагов при сравнении с плацебо – на 53% (во всех случаях р<0,0001).
Клиническая эффективность Плегриди была зафиксирована уже через 6 месяцем после начала его введения 1 раз в 2 недели в дозе 125 мкг, одновременно с этим при сравнении с плацебо снизилось на 61% количество новых и впервые увеличившихся Т2-очагов. Согласно данным магнитно-резонансной томографии (МРТ) наиболее значительное снижение числа рецидивов и конечных точек за год зарегистрировано у лиц из группы, использующей пэгинтерферон бета-1а по 125 мкг каждые 2 недели, при сравнении с пациентами, получавшими средство каждые 4 недели.
Анализ результатов исследований, длящихся два года, подтвердил сохранение эффективности, фиксируемой через один год терапии. Ретроспективный анализ данных продемонстрировал, что в группе лиц, использовавших лекарственное средство в дозе 125 мкг каждые 2 недели, в сравнении с группой, получавшей его каждые 4 недели, была достоверно меньше частота возникновения конечных точек, в т. ч. ежегодная частота рецидивов (на 24%, р = 0,0209), угроза рецидива (на 24%, р = 0,0212), угроза прогрессирования стойкой инвалидизации спустя 24 недели после начала курса лечения (на 36%, р = 0,0459). Была установлена на основании МРТ-обследования меньшая частота развития конечных точек – количество Т1-гипоинтенсивных очагов на 53%, новых или впервые увеличившихся Т2-очагов – на 60%, ГД+-очагов – на 71% (для всех р < 0,0001).
Фармакокинетика
Период полувыведения (Т1/2) из плазмы крови пэгинтерферона бета-1а является более длительным, чем таковой у непэгилированного интерферона бета-1а. В ходе исследований с однократным и многократным введением Плегриди установлено, что уровень его действующего вещества зависел от дозы, варьирующей от 63 до 188 мкг. Наблюдаемые у больных с рассеянным склерозом параметры фармакокинетики пэгинтерферона бета-1а отвечали соответствующим характеристикам у здоровых добровольцев.
Cmax пэгинтерферона бета-1а в плазме крови после его п/к введения больным с рассеянным склерозом отмечалась спустя 1–1,5 дня. После многократного использования Плегриди каждые 2 недели в дозе 125 мкг его Cmax (среднее значение ± стандартная ошибка) была равна (280 ± 79) пг/мл.
В случае однократного п/к введения пэгинтерферона бета-1а в дозах 63, 125 и 188 мкг (что эквивалентно 6, 12 и 18 ММЕ) определялись соответственно в среднем в 4, 9 и 13 раз большая экспозиция (AUC168 ч) и приблизительно в 2; 3,5 и 5 раз большее значение Cmax по сравнению с такими же показателями непэгилированного интерферона бета-1 при его в/м инъекции в дозе 30 мкг (6 ММЕ).
После многократного п/к введения Плегриди каждые 2 недели в дозе 125 мкг объем распределения (Vd) действующего вещества без коррекции на биодоступность (среднее значение ± стандартная ошибка) был равен 481 ± 105 л.
Основным путем экскреции пэгинтерферона бета-1а является почечный клиренс. Фрагмент полиэтиленгликоля, ковалентно связанный с интерфероном бета-1а (белком), способен in vivo изменять свойства немодифицированного белка, в т. ч. снижать почечный клиренс и уменьшать протеолиз, тем самым приводя к удлинению Т1/2 из кровотока. Следовательно, у здоровых добровольцев Т1/2 для пэгинтерферона бета-1а приблизительно в 2 раза длиннее, чем для непэгилированного интерферона бета-1а. У больных с рассеянным склерозом в равновесном состоянии Т1/2 (среднее значение ± стандартная ошибка) пэгинтерферона бета-1а составил 78 ± 15 часов, а среднее значение клиренса – 4,1 ± 0,4 л/час.
Согласно результатам популяционного анализа фармакокинетики пэгинтерферона бета-1а, пол и раса пациентов не оказывают влияния на фармакокинетические параметры данного активного вещества.
В процессе доклинических исследований безопасности Плегриди на животных, признаков токсичности на фоне п/к введений доз, в 55 раз превосходящих терапевтическую, установленную в мг на 1 кг веса тела, обнаружено не было.
В ходе испытаний на обратные мутации у бактерий in vitro (тест Эймса на индукцию генных мутаций), а также кластогенной активности в исследовании на лимфоцитах человека in vitro пэгинтерферон бета-1а не продемонстрировал мутагенной активности.
Исследования канцерогенности действующего вещества на животных не проводились.
Показания к применению
Плегриди рекомендован для терапии ремиттирующего рассеянного склероза у взрослых.
Противопоказания
Абсолютными противопоказаниями для терапии препаратом Плегриди являются:
- детский и подростковый возраст до 18 лет;
- выраженная депрессия и/или суицидальные мысли;
- повышенная чувствительность к пэгинтерферону, рекомбинантному/естественному интерферону или любому дополнительному компоненту.
Кроме того, противопоказано начинать курс лечения у женщин в период установленной беременности.
Плегриди, инструкция по применению: способ и дозировка
Раствор Плегриди вводят п/к.
К терапии препаратом необходимо приступать под наблюдением врача, обладающего опытом лечения рассеянного склероза.
Сведений об эффективности уколов Плегриди при сравнении с непэгилированным интерфероном бета, а также при переводе больных на лечение препаратом после применения непэгилированного интерферона бета, нет. Этот факт требуется брать во внимание при замене пэгилированного интерферона непэгилированным, либо в случае замены последнего Плегриди.
Как правило, инъекции рекомендуется производить под кожу плеча, бедра или живота. Рекомендуемая терапевтическая доза средства – 125 мкг 1 раз в 14 дней.
Упаковка, предназначенная для начала лечения, включает две дозы Плегриди для первых двух инъекций – 63 и 94 мкг.
Схема подбора дозы в начале курса терапии, 1 введение – каждые 14 дней (указана маркировка соответствующего шприца/шприц-ручки):
- I доза: день 1-й – дозировка 63 мкг, оранжевый цвет;
- II доза: день 14-й – дозировка 94 мкг, голубой цвет;
- III доза: день 28-й – дозировка 125 мкг (полная доза), серый цвет.
Далее каждые 14 дней, как и в день 28-й, следует вводить полную дозу – 125 мкг.
Постепенное повышение дозы в начале курса содействует лучшей переносимости возникающих иногда в начале применения интерферонов гриппоподобных симптомов. Предотвратить или снизить степень выраженности данных побочных реакций может профилактический или сопутствующий прием противовоспалительных, жаропонижающих и/или обезболивающих препаратов.
В случае пропуска очередной дозы, если до проведения следующей плановой инъекции Плегриди осталось 7 или более дней, пропущенную дозу нужно ввести как можно быстрее, а следующую – согласно плану. Если же до следующей плановой инъекции осталось менее 7 дней, надлежит немедленно ввести пропущенную дозу и начать новый график плановых введений (1 раз в 2 недели) со дня инъекции пропущенной дозы. Вводить раствор чаще, чем через 7 дней нельзя.
Каждый предварительно заполненный шприц и шприц-ручка предназначены исключительно для однократного использования, их запрещено применять повторно, после введения они должны быть утилизированы.
Перед проведением инъекции препарат, извлеченный из холодильника, требуется согреть до комнатной температуры в естественных условиях, приблизительно на протяжении 30 мин. Применять внешние согревающие источники, например, горячую воду, запрещено. Если содержащийся в предварительно заполненных шприцах и шприц-ручках раствор является мутным или включает видимые частицы, или подвергался замораживанию, то такой препарат использовать нельзя. Раствор должен быть прозрачным, бесцветным или бледно-желтым, также в нем допускается наличие пузырька воздуха.
До выполнения инъекции требуется на чистой, хорошо освещенной и ровной поверхности разместить все необходимые для проведения процедуры материалы, такие как марлевая салфетка, смоченный спиртом ватный тампон, лейкопластырь/фиксирующая повязка, защитный контейнер для утилизации использованных шприцев и шприц-ручек.
После извлечения из холодильника упаковки Плегриди, следует вынуть из нее заполненный шприц или шприц-ручку с дозой, которая соответствует текущему этапу программы. Если в упаковке еще осталось неиспользованное лекарственное средство в шприц-ручке или шприце, ее следует закрыть и положить обратно в холодильник до следующего введения.
Оценив внешний вид раствора и удостоверившись в том, что он соответствует вышеуказанному описанию, после того как препарат достигнет комнатной температуры можно приступать к проведению процедуры. При использовании раствора в шприц-ручке следует убедиться в том, что в окне состояния инъекции видны зеленые полосы.
Плегриди нельзя вводить в те области тела, где в предполагаемом месте инъекции кожа является раздраженной, покрасневшей, инфицированной, или на данном участке имеются кровоподтеки или рубцы. Рекомендуется менять места инъекций и не вводить раствор несколько раз подряд в один и тот же участок.
Удалять колпачок со шприц-ручки или с иглы шприца нужно только после того как все будет готово к выполнению инъекции.
До введения препарата необходимо тщательно вымыть руки водой с мылом. Выбрав в области плеча, живота или бедра участок для проведения инъекции, следует протереть его тампоном, пропитанным спиртом. Перед инъекцией планируемое место введения должно подсохнуть.
Выполнение укола Плегриди при помощи заполненной шприц-ручки:
- Потянуть за колпачок и удалить его, снятый колпачок не надевать обратно. Не прикасаться и не нажимать на защитную насадку, т. к. она закрывает иглу. Остерегаться случайного прикосновения к игле; после снятия колпачка шприц-ручка готова к инъекции.
- Расположить шприц-ручку, прижав ее к поверхности места инъекции под углом 90° таким образом, чтобы иметь возможность видеть в окне состояния зеленые полосы. До тех пор, пока последние не будут видны, не использовать шприц-ручку.
- Прижать шприц-ручку к месту инъекции и удерживать в этом положении, пока в ней не будет прекращено щелканье и не возникнут знаки ✓ (галочки) зеленого цвета. Постоянное придавливание шприц-ручки к месту инъекции содействует введению иглы и началу инъекции.
- Не производить никаких движений до окончания введения раствора, продолжая прижимать шприц-ручку к коже, неподвижно держа под углом 90° до момента завершения инъекции. Во время осуществления введения шприц-ручка несколько раз щелкнет, данные звуки прекратятся после завершения инъекции примерно через 5 сек. Появление в окне состояния зеленых галочек будет свидетельствовать об окончании введения, а заполнение всего окна с препаратом желтым поршнем – об успешном полном использовании всей дозы.
- Удалить шприц-ручку с участка инъекции, подняв ее вверх. Защитная насадка должна полностью закрыть иглу.
Выполнение инъекции Плегриди при помощи заполненного шприца:
- Снять с иглы защитный колпачок и после этого не дотрагиваться до нее.
- Собрать с помощью большого и указательного пальцев руки обработанную спиртом кожу в складку. Держать шприц под углом 90° к участку инъекции.
- Быстро (по типу броска дротика) ввести иглу до самого основания в складку кожи. Отпустить складку после введения. Медленно нажать на поршень одним легким движением, полностью опорожнив шприц на протяжении примерно 5 сек.
- Не извлекать иглу из места инъекции после завершения введения еще в течение 5 сек.
- Удалить иглу, держа шприц в вертикальном положении. Не надевать вновь на иглу защитный колпачок.
После введения Плегриди рекомендуется на протяжении нескольких секунд надавить на место инъекции стерильной марлевой салфеткой. Если наблюдается появление крови, ее следует промокнуть, и наклеить пластырь при необходимости.
Спустя 2 ч после инъекции требуется проверить участок введения раствора на предмет припухлости, покраснения или болезненности. В случае возникновения кожной реакции, которая наблюдается в течение нескольких дней, нужно проконсультироваться с врачом или медсестрой.
Побочные действия
При п/к введении Плегриди каждые 2 недели в дозе 125 мкг наиболее частыми нежелательными явлениями были следующие нарушения: гриппоподобный синдром, эритема в месте инъекции, головная боль, озноб, лихорадка, астения, миалгия, артралгия, боль/зуд в месте инъекции. Побочной реакцией, в большинстве случаев приводившей к отмене лечения, являлся гриппоподобный синдром (менее 1% пациентов).
К нежелательным эффектам, чаще фиксируемым у лиц, которым вводили Плегриди каждые 2 недели в дозе 125 мкг (n = 512), при сравнении с лицами, получавшими на протяжении 48 недель плацебо (n = 500), относились следующие нарушения:
- Центральная и периферическая нервная система: очень часто – головная боль, нечасто – судорожные припадки;
- иммунная система: нечасто – реакция гиперчувствительности;
- кровь и лимфатическая система: нечасто – тромбоцитопения; редко – тромботическая микроангиопатия (ТМА), в т. ч. тромботическая тромбоцитопеническая пурпура (ТТП) / гемолитический уремический синдром (ГУС);
- психика: часто – депрессия;
- скелетно-мышечная и соединительная ткань: очень часто – артралгия, миалгия;
- кожа и подкожно-жировая клетчатка: часто – зуд; нечасто – крапивница;
- желудочно-кишечный тракт (ЖКТ): часто – тошнота, рвота;
- дыхательная система: с неизвестной частотой – легочная артериальная гипертензия;
- почки и мочевыводящие пути: редко – гломерулосклероз, нефротический синдром;
- лабораторные и инструментальные данные: часто – усиление активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и гамма- глутамилтрансферазы (ГГТ), уменьшение числа лейкоцитов, снижение уровня гемоглобина, повышение температуры тела; нечасто – уменьшение числа тромбоцитов;
- общие расстройства и реакции в месте введения: очень часто – озноб, лихорадка, зуд, боль в месте инъекции, эритема в месте введения, астения, гриппоподобный синдром; часто (отмечаемые в месте инъекции) – ощущение тепла, боль, изменение цвета кожи, гипертермия, отек, припухлость, гематома, воспаление, высыпания; редко – некроз в месте инъекции.
Частота возникновения гриппоподобных симптомов, таких как озноб, гиперпирексия, боль, гриппоподобное состояние, миалгия, лихорадка и мышечно-скелетная боль, была наиболее высокой в начале курса терапии. Как правило она уменьшалась на протяжении первых 6 месяцев. Из фиксируемых в период исследований гриппоподобных симптомов 90% по степени тяжести были легкими или средними. Случаи развития данных эффектов в тяжелой степени не отмечались.
Эритема, зуд, боль или отек в месте инъекции были зафиксированы у 66% пациентов, использующих пэгинтерферон бета-1а каждые 2 недели в дозе 125 мкг, в сравнении с 11% пациентов, получавших плацебо. Наиболее частым нарушением являлась эритема в месте инъекции. Из наблюдаемых побочных явлений в месте инъекции до 95% из них по тяжести были легкими или средними. В одном случае (из 1468 пациентов) было зафиксировано развитие некроза, разрешившегося после назначения стандартного лечения.
Реакции гиперчувствительности отмечались у 16% больных, получавших препарат в дозе 125 мкг, и у 14% в группе плацебо. В группе, применявшей Плегриди, менее чем у 1% наблюдались серьезные реакции в виде ангионевротического отека, крапивницы, при этом они быстро купировались после лечения антигистаминными и/или глюкокортикостероидными (ГКС) средствами. При развитии в ходе лечения серьезной реакции гиперчувствительности необходимо отказаться от использования пэгинтерферона бета-1а.
Передозировка
Случаи передозировки препаратом Плегриди не были зафиксированы. При возможном развитии передозировки рекомендуется проведение соответствующего поддерживающего лечения.
Особые указания
На фоне терапии препаратами интерферона бета были отмечены случаи возрастания активности печеночных ферментов, возникновения гепатита, аутоиммунного гепатита и, редко, печеночной недостаточности тяжелой степени. В процессе использования Плегриди фиксировались случаи усиления активности ферментов печени. При использовании препарата пациентам следует находиться под наблюдением для своевременного обнаружения возможных симптомов поражения печени.
При лечении больных с депрессивными расстройствами в анамнезе следует применять Плегриди с осторожностью. Пациентам нужно незамедлительно сообщать своему лечащему врачу о признаках депрессии и/или суицидальных мыслях. Во время терапии необходимо установить тщательный контроль у лиц с депрессией и при необходимости провести соответствующее лечение. Требуется рассмотреть возможность отмены пэгинтерферона бета-1а.
В целях снижения угрозы возникновения реакций в месте инъекции до минимума необходимо осуществлять введение раствора в асептических условиях. В случае образования кожных поражений, сопровождающихся припухлостью и/или оттоком жидкости из участка инъекции, следует срочно обратиться к врачу.
На фоне применения Плегриди отмечались цитопении, в т. ч. редкие случаи тяжелой тромбоцитопении и нейтропении. В период лечения требуется проводить мониторинг симптомов или признаков уменьшения количества форменных элементов периферической крови.
При терапии интерфероном бета были зафиксированы случаи возникновения нефротического синдрома при имеющихся различных нефропатиях, в т. ч. таких как липоидный нефроз (ЛН), склерозирующий гломерулонефрит, фокально-сегментарный гломерулосклероз (ФСГ), мембранозная гломерулопатия (МГП) и мембранозно-пролиферативный гломерулонефрит (МПГН). Данные явления наблюдались на разных фазах лечения и могли развиваться спустя несколько лет после использования интерферона бета. В процессе лечения препаратом следует периодически проводить обследования в целях обнаружения ранних признаков этих осложнений, например, протеинурии, отеков и нарушений деятельности почек, особенно при наличии повышенной угрозы поражения почек. Необходима своевременная терапия нефротического синдрома, а также оценка целесообразности прекращения или продолжения применения Плегриди.
В период терапии интерфероном бета зафиксированы случаи ТМА (в т. ч. со смертельным исходом), проявлявшейся в виде ТТП или ГУС. Данные осложнения отмечались на разных этапах использования препарата и могли появляться спустя несколько недель/лет после начала курса. К их ранним клиническим признакам относятся лихорадка, тромбоцитопения, впервые возникшая артериальная гипертензия, парезы, спутанность сознания, функциональные нарушения почек. Лабораторные данные подозреваемой ТМА включают уменьшение количества тромбоцитов и возрастание активности лактатдегидрогеназы (ЛДГ) в мазке крови. При обнаружении клинических признаков ТМА следует осуществить дополнительные исследования содержания тромбоцитов, уровня ЛДГ, мазков крови и деятельности почек. В случае подтверждения диагноза требуется незамедлительно прекратить использование Плегриди и провести соответствующее лечение, в т. ч. обменное переливание плазмы.
Терапия интерферонами протекает с изменением лабораторных показателей. До применения Плегриди, регулярно после начала курса и далее периодически (в случае отсутствия клинических симптомов), кроме стандартных лабораторных тестов, назначаемых пациентам с рассеянным склерозом, рекомендуется осуществлять полный клинический анализ крови в т. ч. с подсчетом числа тромбоцитов и биохимический анализ крови, включающий функциональные печеночные пробы (уровни АЛТ и АСТ). Больным с миелосупрессией может быть необходим интенсивный контроль показателей анализа крови с подсчетом количества форменных элементов и тромбоцитов.
С особой осторожностью следует вводить Плегриди пациентам с указаниями в анамнезе на судорожные припадки, или принимающим противоэпилептические средства, в особенности, если эпилепсия является недостаточно контролируемой.
Пациенты с тяжелыми поражениями сердца в анамнезе, включающими заболевание коронарных артерий, застойную сердечную недостаточность, аритмию, при проведении терапии нуждаются в постоянном контроле, главным образом в начале курса, для выявления возможного усугубления тяжести симптомов.
Влияние на способность к управлению автотранспортом и сложными механизмами
Возникающие на фоне лечения побочные эффекты со стороны центральной и периферической нервной системы, такие как тошнота, могут оказать влияние на способность к вождению автомобиля и выполнению потенциально опасных видов деятельности, которые требуют усиленной концентрации внимания и быстроты реакций.
Применение при беременности и лактации
В процессе лечения препаратом женщинам с сохраненным детородным потенциалом необходимо использовать наиболее эффективные методы контрацепции.
Если во время терапии произошло непреднамеренное зачатие или планируется беременность, женщину необходимо проинформировать о потенциальных рисках, а также требуется рассмотреть вопрос о прекращении использования Плегриди. При наличии до начала курса лечения высокой частоты рецидивов следует произвести тщательную оценку угрозы выраженного рецидива после отмены препарата в результате беременности и повышенного риска спонтанного аборта в период лечения.
Данные по использованию пэгинтерферона бета-1а у беременных ограничены, полученные сведения указывают на усугубление риска спонтанного аборта. Во время беременности начинать терапию препаратом противопоказано.
Экскретируется ли пэгинтерферон бета-1а с материнским молоком человека не определено. Принимая во внимание возможность возникновения серьезных побочных явлений у новорожденного, при необходимости терапии в период лактации требуется прекратить грудное вскармливание.
Сведений о воздействии пэгинтерферона бета-1а на фертильность человека не имеется. Ановуляторные эффекты у животных регистрировались при использовании лекарственного препарата в очень больших дозах.
Применение в детском возрасте
У детей и подростков эффективность и безопасность иммуномодулирующего средства не была изучена, вследствие этого пациентам младше 18 лет терапия препаратом Плегриди противопоказана.
При нарушениях функции почек
Основываясь на результатах клинических исследований, при наличии легкой, средней или тяжелой степени почечной недостаточности, а также при терминальной стадии поражения почек, корректировать дозы Плегриди не требуется. Тем не менее пациентам с тяжелой степенью почечной недостаточностью рекомендуется проводить терапию препаратом с особой осторожностью.
При нарушениях функции печени
Оценка фармакокинетических параметров пэгинтерферона бета-1а у больных с печеночной недостаточностью не проводилась.
На фоне тяжелой печеночной недостаточности Плегриди требуется использовать с осторожностью под тщательным медицинским контролем. В период терапии пациентам необходимо периодически проводить обследования на наличие признаков поражения печени.
Применение в пожилом возрасте
Ввиду ограниченного количества пожилых пациентов, включенных в проведение клинических исследований, безопасность и эффективность Плегриди для терапии данной возрастной группы изучена недостаточно. Однако, согласно результатам, полученным с помощью популяционного анализа фармакокинетических данных у лиц до 65 лет, возраст не оказывает влияния на клиренс пэгинтерферона бета-1а.
Лекарственное взаимодействие
Исследования взаимодействия пэгинтерферона бета-1а с другими лекарственными веществами/препаратами не проводились.
На основании клинических данных, больные с рассеянным склерозом могут применять Плегриди в комбинации с ГКС в период рецидивов заболевания.
Следует учитывать, что у человека и животных интерфероны ослабляют активность печеночных изоферментов системы цитохрома Р450. Рекомендуется с особой осторожностью использовать пэгинтерферон бета-1а в сочетании с лекарственными средствами, характеризующимися узким терапевтическим индексом, у которых клиренс в значительной степени зависит от системы цитохрома Р450 микросом печени, в частности, с антидепрессантами и определенными классами противоэпилептических препаратов.
Аналоги
Аналогами Плегриди являются Авонекс, Ребиф, Бетаферон, Интераль-П, Ронбетал, Экставиа.
Сроки и условия хранения
Хранить в месте, недоступном для детей, защищенном от света, при температуре от 2 до 8 °C, не замораживая.
Срок годности – три года.
При отсутствии холодильника раствор можно хранить в месте, защищенном от света, при температуре до 25 °C, не более 30 дней.
Условия отпуска из аптек
Отпускается по рецепту.
Отзывы о Плегриди
На специализированных сайтах и форумах, посвященных обсуждению методов лечения ремиттирующего рассеянного склероза у взрослых, крайне мало отзывов о Плегриди. В основном пациенты в них отмечают эффективность препарата и его пролонгированное действие, что позволяет снизить частоту введений до 1 инъекции в 14 дней. Данный факт повышает приверженность больных к терапии.
Вместе с тем на фоне лечения препаратом все указывают на возникновение выраженных побочных эффектов, преимущественно в виде наблюдаемого в течение 2 суток после введения Плегриди гриппоподобного состояния.
Цена на Плегриди в аптеках
Цена на Плегриди, раствор для п/к введения (125 мкг/0,5 мл), может составлять 24 300 руб. за упаковку, содержащую 2 шприца по 0,5 мл.
Плегриди: цены в интернет-аптеках
Название препарата Цена Аптека |
Об авторе

Диплом по специальности «Фармация», Образовательная организация дополнительного профессионального образования «Международная академия экспертизы и оценки»
Диплом по специальности «Фармацевтическая технология», ООО «Национальный центр медицинского образования» совместно с Федеральным государственным бюджетным учреждением дополнительного профессионального образования «Всероссийским учебно-научно-медицинским центром по непрерывному фармацевтическому и медицинскому образованию»
Информация о препарате является обобщенной, предоставляется в ознакомительных целях и не заменяет официальную инструкцию. Самолечение опасно для здоровья!
Первый вибратор изобрели в 19 веке. Работал он на паровом двигателе и предназначался для лечения женской истерии.